Konfiguracja elektronowa
Liczby kwantowe
służą do opisu poziomu energetycznego, na którym znajduje się elektron.Kolejne liczby kwantowe to:
- główna liczba kwantowa (symbol n); określa przedział energetyczny, w którym zawiera się energia elektronu, przyjmuje ona kolejne wartości liczb naturalnych (n=1,2,3,4…); zbiór stanów kwantowych opisanych taką samą główną liczbą kwantową, nazywa się poziomem energetycznym lub powłoką elektronową;- orbitalna liczba kwantowa (symbol l); wskazuje dokładnie energię elektronu, określa również jego moment pędu; wartości, jakie przyjmuje to kolejne liczby naturalne od 0 do n-1; zbiór stanów kwantowych opisanych taką samą główną liczbą kwantową (n) oraz taką samą poboczna liczba kwantową (l), nazywa się podpoziomem energetycznym (podpowłoką);
-magnetyczna liczba kwantowa (symbol m), określa rzut wektora momentu pęd na wyróżniony kierunek w przestrzeni, przyjmując wartości wszystkich liczb całkowitych w zakresie od -l (minus el) do +l (plus el) w tym 0 (zero); stan kwantowy opisany tymi samymi liczbami: n, l, m nosi nazwę poziomu orbitalnego; liczba poziomów orbitalnych dla poszczególnych powłok odpowiada kolejnym nieparzystym liczbom naturalnym
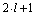
-magnetyczna spinowa liczba kwantowa (symbol s) jest związana z własnym momentem pędu elektronu, określa ona rzut wektora własnego momentu pędu elektronu na wyróżniony w przestrzeni kierunek i przyjmuje wartości (-1/2; +1/2)
Powłoka elektronowa
- poziom energetyczny, na którym znajduje się elektron/ zbiór elektronów o zbliżonej energii. Powłoce odpowiada zbiór orbitali atomowych mających tę samą główną liczbę kwantową (n) Kolejne wartości głównej liczby kwantowej (n) oznacza się symbolem dużych liter: K, L, M, N, O, P, Q.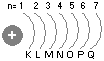
Powłoki składają się z różnej liczby podpowłok elektronowych, odpowiadających określonym rodzajom orbitali atomowych. Oznaczenia orbitali, to symbole małych liter: s, p, d, f…
Liczba powłok elektronowych w atomie danego pierwiastka jest równa numerowi okresu, do którego należy ten pierwiastek.
Maksymalna liczba elektronów w powłoce jest równa zależności
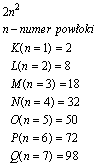
Elektrony walencyjnej
Elektrony walencyjne są to elektrony biorące udział w tworzeniu wiązań chemicznych, są one słabo związane z jądrem atomowym- poruszają się w zewnętrznych powłokach atomu.Elektronami walencyjnymi atomów pierwiastków grup głównych są elektrony znajdujące się w zewnętrznej powłoce i ich liczba jest równa cyfrze jedności w numerze oznaczającym grupę w tablicy układu okresowego. W atomach pozostałych pierwiastków, elektronami walencyjnymi są elektrony z zewnętrznej powłoki oraz niektóre elektrony z powłok położonych głębiej.
Rdzeń atomowy
- pojęcie określające część atomu składającą się z jądra i elektronów niewalencyjnych (nie uczestniczą one w tworzeniu wiązań chemicznych).Powłokowa konfiguracja elektronowa
Powłokowa konfiguracja elektronowa opisuje rozmieszczenie elektronów w powłokach. Zapisuje się ją w postaci kolejnych liter alfabetu przyjętych za symbole głównych liczb kwantowych (K,L,M…) na przykład dla żelaza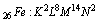
Konfiguracja walencyjna
Konfiguracja walencyjna jest fragmentem konfiguracji elektronowej, która dotyczy elektronów walencyjnych, na przykład dla żelaza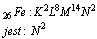
Podpowłoki elektronowe
Podpowłoka elektronowa, to grupa elektronów o równych energiach. Ilość podpowłok w danej powłoce elektronowej jest równa numerowi powłoki. Podpowłoki oznacza się symbolami małych liter (s, p, d, f, g, h itd.). Dodatkowo przy do każdej podpowłoki przypisuje się numer powłoki, do której należy (np. 3p oznacza podpowłokę p trzeciej powłoki). Podpowłoka (s) może maksymalnie zwierać 2 elektrony. Każda następna podpowłoka może posiadać o 4 elektrony więcej niż podpowłoka ją poprzedzająca (s=2, p=6, d=10, f=14 itd.)Podpowłokowa konfiguracja elektronowa
Podpowłokowa konfiguracja elektronowa jest to zapis rozmieszczenia elektronów w powłokach i podpowłokach.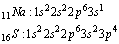
Reguła Hunda
- liczba niesparowanych elektronów w danej podpowłoce powinna być możliwie jak najmniejsza- pary elektronów tworzą się dopiero po zapełnieniu wszystkich poziomów orbitalnych danej podpowłoki przez elektrony niesparowane. (w jednym orbitalu mogą znajdować się maksymalnie dwa elektrony o przeciwnych spinach, te elektrony nazywa się sparowane)
- elektrony niesparowane w poziomach orbitalnych danej podpowłoki maja jednakową orientację spinu










