W stanie równowagi układu:
N2+3H2<-> 2NH3W stanie równowagi układu:
N2+3H2<-> 2NH3
stężenia wynosiły: azotu 3mol/dm3, wodoru 9mol/dm3, amoniaku 4mol/dm3. Obliczyć stężenia wyjściowe wodoru i azotu.
Rozwiązanie wybranego zadania z chemii
Zapis reakcji:
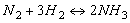
Wskazówka: Przyjmiemy, że objętość układu wynosi 1dm3 i początkowe stężenie amoniaku wynosi zero. Na podstawie podanej reakcji ułożymy proporcję i obliczymy ile moli azotu oraz wodoru zużyto do wytworzenia 4moli amoniaku:
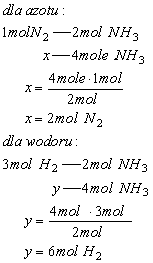
Szukane początkowe stężenia substratów wynoszą:

N2+3H2<-> 2NH3
stężenia wynosiły: azotu 3mol/dm3, wodoru 9mol/dm3, amoniaku 4mol/dm3. Obliczyć stężenia wyjściowe wodoru i azotu.